Peptida adalah kelas senyawa yang dibentuk oleh hubungan beberapa asam amino melalui ikatan peptida. Mereka ada di mana -mana dalam organisme hidup. Hingga kini, puluhan ribu peptida telah ditemukan dalam organisme hidup. Peptida memainkan peran penting dalam mengatur aktivitas fungsional berbagai sistem, organ, jaringan dan sel dan dalam aktivitas kehidupan, dan sering digunakan dalam analisis fungsional, penelitian antibodi, pengembangan obat dan bidang lainnya. Dengan pengembangan teknologi bioteknologi dan sintesis peptida, semakin banyak obat peptida telah dikembangkan dan diterapkan di klinik.
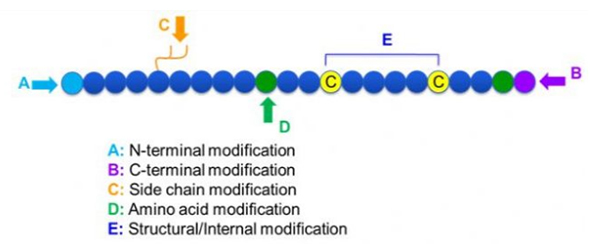
Ada berbagai macam modifikasi peptida, yang dapat dengan mudah dibagi menjadi modifikasi pasca modifikasi dan proses modifikasi (menggunakan modifikasi asam amino turunan), dan modifikasi N-terminal, modifikasi terminal-C, modifikasi rantai samping, modifikasi asam amino, modifikasi kerangka, dll., Tergantung pada lokasi modifikasi (Gambar 1). Sebagai cara penting untuk mengubah struktur rantai utama atau kelompok rantai samping rantai peptida, modifikasi peptida dapat secara efektif mengubah sifat fisik dan kimia senyawa peptida, meningkatkan kelarutan air, memperpanjang waktu aksi dalam vivo, mengubah distribusi biologisnya, menghilangkan imunogenitas, mengurangi efek samping yang beracun, dll. Dalam makalah ini, beberapa strategi modifikasi besarnya dan pengkhianatannya.
1. Siklisasi
Peptida siklik memiliki banyak aplikasi dalam biomedis, dan banyak peptida alami dengan aktivitas biologis adalah peptida siklik. Karena peptida siklik cenderung lebih kaku daripada peptida linier, mereka sangat tahan terhadap sistem pencernaan, dapat bertahan hidup di saluran pencernaan, dan menunjukkan afinitas yang lebih kuat untuk reseptor target. Siklisasi adalah cara paling langsung untuk mensintesis peptida siklik, terutama untuk peptida dengan kerangka struktural yang besar. Menurut mode siklisasi, itu dapat dibagi menjadi tipe rantai sisi rantai samping, tipe terminal - rantai samping, terminal - tipe terminal (tipe ujung ke ujung).
(1) Sidechain-to-Sidechain
Jenis siklisasi rantai samping ke rantai samping yang paling umum adalah disulfida yang menjembatani antara residu sistein. Siklisasi ini diperkenalkan oleh sepasang residu sistein yang dideproteksi dan kemudian dioksidasi untuk membentuk ikatan disulfida. Sintesis polycyclic dapat dicapai dengan menghilangkan selektif kelompok perlindungan sulfhidril. Siklisasi dapat dilakukan baik dalam pelarut pasca-disosiasi atau pada resin pra-disosiasi. Siklisasi pada resin mungkin kurang efektif daripada siklisasi pelarut karena peptida pada resin tidak dengan mudah membentuk konformasi siklus. Jenis lain dari siklisasi rantai samping - rantai samping adalah pembentukan struktur amida antara asam aspartat atau residu asam glutamat dan asam amino basa, yang mensyaratkan bahwa kelompok perlindungan rantai samping harus dapat dihilangkan secara selektif dari polipeptida baik pada resin atau setelah disosiasi. Jenis ketiga dari siklisasi rantai samping-rantai samping adalah pembentukan eter difenil oleh tirosin atau p-hydroxyphenylglycine. Jenis siklisasi dalam produk alami ini hanya ditemukan dalam produk mikroba, dan produk siklisasi sering kali memiliki nilai obat potensial. Persiapan senyawa ini membutuhkan kondisi reaksi yang unik, sehingga tidak sering digunakan dalam sintesis peptida konvensional.

(2) Terminal-to-Sidechain
Siklisasi rantai sisi terminal biasanya melibatkan terminal-C dengan gugus amino lisin atau rantai samping ornithine, atau terminal-N dengan asam aspartat atau rantai samping asam glutamat. Siklisasi polipeptida lain dibuat dengan membentuk ikatan eter antara terminal C dan serin atau rantai samping treonin.
(3) Jenis terminal atau head-to-tail
Polipeptida rantai dapat bersepeda dalam pelarut atau difiksasi pada siklasi resin dengan rantai samping. Konsentrasi peptida yang rendah harus digunakan dalam sentralisasi pelarut untuk menghindari oligomerisasi peptida. Hasil polipeptida cincin sintetis head-to-tail tergantung pada urutan polipeptida rantai. Oleh karena itu, sebelum menyiapkan peptida siklik dalam skala besar, perpustakaan peptida timbal yang mungkin pertama harus dibuat, diikuti oleh siklisasi untuk menemukan urutan dengan hasil terbaik.
2. N-metilasi
N-metilasi yang awalnya terjadi pada peptida alami dan diperkenalkan ke dalam sintesis peptida untuk mencegah pembentukan ikatan hidrogen, sehingga membuat peptida lebih tahan terhadap biodegradasi dan pembersihan. Sintesis peptida menggunakan turunan asam amino N-metilasi adalah metode yang paling penting. Selain itu, reaksi mitsunobu dari intermediet polipeptida-resin N- (2-nitrobenzene sulfonyl klorida) dengan metanol juga dapat digunakan. Metode ini telah digunakan untuk menyiapkan pustaka peptida siklik yang mengandung asam amino N-metilasi.
3. Fosforilasi
Fosforilasi adalah salah satu modifikasi pasca-translasi yang paling umum di alam. Dalam sel manusia, lebih dari 30% protein difosforilasi. Fosforilasi, terutama fosforilasi reversibel, memainkan peran penting dalam mengendalikan banyak proses seluler, seperti transduksi sinyal, ekspresi gen, siklus sel dan regulasi sitoskeleton, dan apoptosis.
Fosforilasi dapat diamati pada berbagai residu asam amino, tetapi target fosforilasi yang paling umum adalah residu serin, treonin, dan tirosin. Turunan fosfotyrosine, fosfothreonine, dan fosfoserin dapat dimasukkan ke dalam peptida selama sintesis atau terbentuk setelah sintesis peptida. Fosforilasi selektif dapat dicapai dengan menggunakan residu serin, treonin, dan tirosin yang secara selektif menghilangkan kelompok pelindung. Beberapa reagen fosforilasi juga dapat memperkenalkan gugus asam fosfat ke dalam polipeptida dengan pasca modifikasi. Dalam beberapa tahun terakhir, fosforilasi lisin spesifik lokasi telah dicapai dengan menggunakan reaksi staudinger-fosfit yang secara kimia selektif (Gambar 3).

4. Myristoylation dan palmitoylation
Acylation N-terminal dengan asam lemak memungkinkan peptida atau protein mengikat membran sel. Urutan myridamoylated pada terminal-N memungkinkan protein kinase keluarga SRC dan protein Gaq transkriptase terbalik yang ditargetkan untuk mengikat membran sel. Asam myristic terkait dengan terminal-N dari resin-polipeptida menggunakan reaksi kopling standar, dan lipopeptida yang dihasilkan dapat dipisahkan dalam kondisi standar dan dimurnikan dengan RP-HPLC.
5. Glikosilasi
Glikopeptida seperti vankomisin dan teicolanin adalah antibiotik penting untuk pengobatan infeksi bakteri yang resistan terhadap obat, dan glikopeptida lain sering digunakan untuk merangsang sistem kekebalan tubuh. Selain itu, karena banyak antigen mikroba glikosilasi, sangat penting untuk mempelajari glikopeptida untuk meningkatkan efek terapi infeksi. Di sisi lain, telah ditemukan bahwa protein pada membran sel sel tumor menunjukkan glikosilasi abnormal, yang membuat glikopeptida memainkan peran penting dalam penelitian pertahanan kekebalan kanker dan tumor. Glikopeptida disiapkan dengan metode FMOC/T-BU. Residu glikosilasi, seperti treonin dan serin, sering dimasukkan ke dalam polipeptida oleh pentafluorofenol ester yang diaktifkan FMOC untuk melindungi asam amino glikosilasi.
6. Isoprene
Isopentadienilasi terjadi pada residu sistein di rantai samping dekat terminal-C. Protein isoprene dapat meningkatkan afinitas membran sel dan membentuk interaksi protein-protein. Protein isopentadienasi termasuk tirosin fosfatase, gtase kecil, molekul cochaperone, lamina nuklir, dan protein pengikat sentromerik. Polipeptida isoprene dapat disiapkan menggunakan isoprene pada resin atau dengan memperkenalkan turunan sistein.
7. Modifikasi Polyethylene Glycol (PEG)
Modifikasi PEG dapat digunakan untuk meningkatkan stabilitas hidrolitik protein, biodistribusi dan kelarutan peptida. Pengenalan rantai PEG ke peptida dapat meningkatkan sifat farmakologisnya dan juga menghambat hidrolisis peptida oleh enzim proteolitik. PEG peptida melewati penampang kapiler glomerular lebih mudah daripada peptida biasa, sangat mengurangi pembersihan ginjal. Karena waktu paruh aktif yang diperpanjang dari peptida PEG in vivo, tingkat pengobatan normal dapat dipertahankan dengan dosis yang lebih rendah dan obat peptida yang lebih jarang. Namun, modifikasi PEG juga memiliki efek negatif. Sejumlah besar PEG mencegah enzim menurunkan peptida dan juga mengurangi ikatan peptida ke reseptor target. Tetapi afinitas rendah peptida PEG biasanya diimbangi oleh waktu paruh farmakokinetik yang lebih panjang, dan dengan hadir dalam tubuh lebih lama, peptida PEG memiliki kemungkinan lebih besar untuk diserap ke dalam jaringan target. Oleh karena itu, spesifikasi polimer PEG harus dioptimalkan untuk hasil yang optimal. Di sisi lain, peptida PEG menumpuk di hati karena berkurangnya clearance ginjal, menghasilkan sindrom makromolekul. Oleh karena itu, modifikasi PEG perlu dirancang lebih hati -hati ketika peptida digunakan untuk pengujian obat.

Common modification groups of PEG modifiers can be roughly summarized as follows: Amino (-amine) -NH2, aminomethyl-Ch2-NH2, hydroxy-OH, carboxy-Cooh, sulfhydryl (-Thiol) -SH, Maleimide -MAL, succinimide carbonate -SC, succinimide acetate -SCM, succinimide propionate -SPA, n-hydroxysuccinimide -NHS, Acrylate-ch2ch2cooh, aldehyde -CHO (such as propional-ald, butyrALD), acrylic base (-acrylate-acrl), azido-azide, biotinyl -Biotin, Fluorescein, glutaryl -GA, Acrylate Hydrazide, alkyne-alkyne, P -TOLUENESULFONATE -OTS, SUCCINIMIDE SUCESTINE -SS, dll. Derivatif PEG dengan asam karboksilat dapat digabungkan dengan amina N -terminal atau rantai samping lisin. PEG yang diaktifkan amino dapat digabungkan dengan asam aspartat atau rantai samping asam glutamat. PEG yang diaktifkan mal dapat dikonjugasikan ke Mercaptan dari rantai samping sistein yang dideproteksi sepenuhnya [11]. Pengubah PEG umumnya diklasifikasikan sebagai berikut (Catatan: MPEG adalah Methoxy-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) pengubah pasak rantai lurus
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-Ald, MPEG-Butyrald, MPEG-SS
(2) pengubah PEG bifungsional
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) pengubah PEG bercabang
(MPEG) 2-NHS, (MPEG) 2-Ald, (MPEG) 2-NH2, (MPEG) 2-MAL
8. Biotinisasi
Biotin dapat sangat terikat dengan avidin atau streptavidin, dan kekuatan pengikat bahkan dekat dengan ikatan kovalen. Peptida berlabel biotin umumnya digunakan dalam immunoassay, histositokimia, dan sitometri aliran berbasis fluoresensi. Antibodi antibiotin berlabel juga dapat digunakan untuk mengikat peptida yang terbiotinilasi. Label biotin sering melekat pada rantai samping lisin atau terminal N. Asam 6-aminocaproic sering digunakan sebagai ikatan antara peptida dan biotin. Ikatan ini fleksibel dalam mengikat substrat dan mengikat lebih baik dengan adanya hambatan sterik.
9. Pelabelan Fluorescent
Pelabelan fluorescent dapat digunakan untuk melacak polipeptida dalam sel hidup dan untuk mempelajari enzim dan mekanisme aksi. Tryptophan (TRP) adalah fluoresen, sehingga dapat digunakan untuk pelabelan intrinsik. Spektrum emisi triptofan tergantung pada lingkungan perifer dan berkurang dengan penurunan polaritas pelarut, properti yang berguna untuk mendeteksi struktur peptida dan pengikatan reseptor. Fluoresensi tryptophan dapat dipadamkan oleh asam aspartat dan asam glutamat yang diprotonasi, yang dapat membatasi penggunaannya. Kelompok Dansyl Chloride (Dansyl) sangat fluorescent ketika terikat pada gugus amino dan sering digunakan sebagai label fluorescent untuk asam amino atau protein.
Konversi energi resonansi fluoresensi (FRET) berguna untuk studi enzim. Ketika FRET diterapkan, polipeptida substrat biasanya mengandung kelompok pelabelan fluoresensi dan kelompok pemadam fluoresensi. Kelompok fluoresen berlabel didinginkan oleh quencher melalui transfer energi non-foton. Ketika peptida dipisahkan dari enzim yang dimaksud, kelompok pelabelan memancarkan fluoresensi.
10. Polipeptida kandang
Peptida kandang memiliki kelompok pelindung yang dapat dilepas secara optik yang melindungi peptida dari ikatan ke reseptor. Ketika terpapar radiasi UV, peptida diaktifkan, mengembalikan afinitasnya dengan reseptor. Karena aktivasi optik ini dapat dikontrol sesuai dengan waktu, amplitudo, atau lokasi, peptida kandang dapat digunakan untuk mempelajari reaksi yang terjadi dalam sel. Kelompok pelindung yang paling umum digunakan untuk polipeptida kandang adalah gugus 2-nitrobenzyl dan turunannya, yang dapat diperkenalkan dalam sintesis peptida melalui turunan asam amino pelindung. Turunan asam amino yang telah dikembangkan adalah lisin, sistein, serin, dan tirosin. Turunan aspartat dan glutamat, bagaimanapun, tidak umum digunakan karena kerentanannya terhadap siklisasi selama sintesis dan disosiasi peptida.
11. Peptida Polyantigenic (MAP)
Peptida pendek biasanya tidak kebal dan harus digabungkan dengan protein pembawa untuk menghasilkan antibodi. Peptida polyantigenic (MAP) terdiri dari beberapa peptida identik yang terhubung ke nukleus lisin, yang secara khusus dapat mengekspresikan imunogen potensi tinggi dan dapat digunakan untuk menyiapkan bait protein pembawa peptida. Polipeptida MAP dapat disintesis dengan sintesis fase padat pada resin MAP. Namun, kopling yang tidak lengkap menghasilkan rantai peptida yang hilang atau terpotong pada beberapa cabang dan dengan demikian tidak menunjukkan sifat -sifat polipeptida peta asli. Sebagai alternatif, peptida dapat disiapkan dan dimurnikan secara terpisah dan kemudian digabungkan ke peta. Urutan peptida yang melekat pada inti peptida terdefinisi dengan baik dan mudah ditandai oleh spektrometri massa.
Kesimpulan
Modifikasi peptida adalah cara penting untuk merancang peptida. Peptida yang dimodifikasi secara kimia tidak hanya dapat mempertahankan aktivitas biologis yang tinggi, tetapi juga secara efektif menghindari kelemahan imunogenisitas dan toksisitas. Pada saat yang sama, modifikasi kimia dapat memberikan peptida dengan beberapa sifat baru yang sangat baik. Dalam beberapa tahun terakhir, metode aktivasi C-H untuk post-modifikasi polipeptida telah dikembangkan dengan cepat, dan banyak hasil penting telah tercapai.
Waktu posting: 2025-07-03
